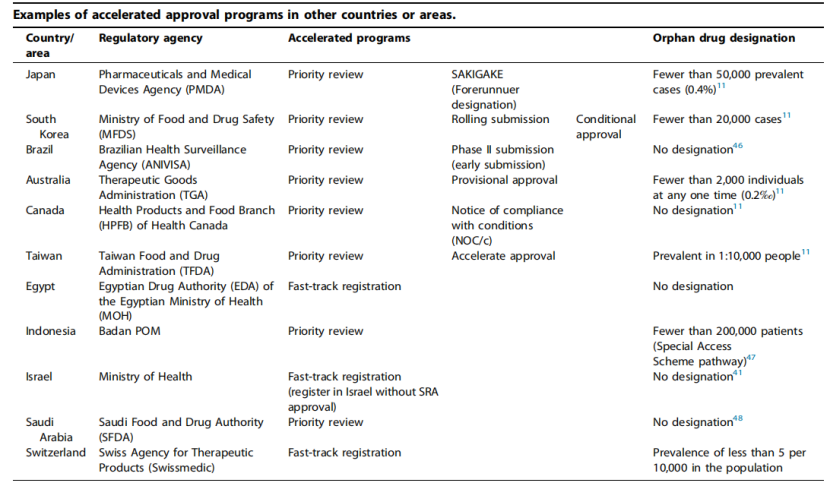
为了缩小与FDA和EMA等成熟监管机构审评效率的差距,全球其他国家也正努力建设敏捷监管体系下的药物加速审批路径(表1)。从全球来看,主要市场和新兴市场在过去10年都已经建立了加速审评或附条件批准的路径。有些路径甚至通过高药品定价和专有市场保护来进一步激励申请方。
日前,Drug discovery today杂志(IF:7.851)在线发表了中国医学科学院肿瘤医院/药物临床试验研究中心(GCP)李宁教授、王书航博士团队的研究报告,系统回顾了全球加速批准罕见肿瘤新药波澜壮阔的10年历程。
医药魔方Med经授权编译,陆续向大家介绍美国、中国以及全球多个国家使用的加速审批路径和孤儿药资格认定政策,以及过去10年来通过这些路径批准的肿瘤药物。本文为系列报道第三篇——全球篇。
本文目的不是详尽阐述每个国家监管体系的细微差别,而是重点突出各种监管系统运行中的关键主题,并给出与各个国家监管机构相关的示例。
表1:其他国家或地区的加速审批程序
合作审批与监管互信
随着世界经济和医疗系统日益全球化,监管机构之间通过合作审批提高效率的时机已经成熟,基于协调全球各国监管体系而实行监管互信是一种越来越受欢迎的审评策略。比如一家监管机构(如瑞士药品管理局,Swissmedic)可以根据全球卫生产品上市许可(Marketing Authorization for Global Health Products,MAGHP)对面向外国市场的产品提供监管意见。而某些国家和地区(例如墨西哥、印度尼西亚、巴拿马和台湾)为了缓解自身的审评负担,会允许一些在其他国家按严格审评标准批准的药物直接在本地上市销售。
另一种互信方式是墨西哥、哥斯达黎加和新加坡国家采用的等效性协议,只针对性地审查适用本地监管要求的上市申请资料中的关键部分,大幅缩短审批时间。通过等效性协议路径批准的药物通常可以将审批时间从一年以上缩短至约3或4个月。
其他国际监管合作项目
其他促进国际监管合作的项目也在陆续出台。来自澳大利亚、加拿大和美国的监管机构联盟于2019年9月召开会议,启动Orbis项目,这是一种在多个国家同时提交和审查肿瘤适应症相关药物上市申请资料的新策略。Orbis项目召开的首次会议是讨论一种用于治疗子宫内膜癌的新疗法,该战略合作在一定程度上解决当地监管机构的申请程序阻碍新药快速开发的问题。事实上,类似的国际间合作早在2004年就已经开始探索。FDA和NMPA之间的会议也每季度举行一次,以协调监管标准。
多种加速审批路径
全球各个国家还在实施其他多种加速审批路径,以满足潜在的医疗需求。加速审批路径被多个国家用于促进药物的快速批准,包括沙特阿拉伯、巴西和以色列。例如,根据沙特食品药品监督管理局(SFDA)的规定,用于治疗严重或危及生命的疾病的药物、解决未满足医疗需求的药物、被列入豁免清单的药物首仿或第2家仿制药物,相比常规注册路径可以节约40%的时间。
此外,韩国允许申请人在滚动申请的基础上按监管要求分模块提交数据。巴西和台湾可以受理基于替代终点或II期研究数据提交的上市申请并做出附条件批准。需要指出的是,获得孤儿药资格在日本可以普遍享受优先审评,这与美国和欧盟的孤儿药通道并不相同。
向申办方提供财政奖励
除了提高上市申请资料的处理效率之外,其他国家还向申办方提供财政奖励以激励他们寻求加速获得许可。日本PMDA在2015年启动Sakigake项目,该路径下批准的药物在上市后获得10%-20%的药品定价加价。加拿大则由加拿大基因组和加拿大卫生研究所等机构提供的资助计划来分担申请人的早期临床前研究成本。
随着全球的监管审批路径变得标准化和统一,各国之间能够更好地进行合作,药物获批的中位时间必然会大大缩短,以填补之前未满足的医疗需求。
包括推出不久的Sakigake计划已经做出了37项认定,截至2020年8月已经有10个药物获得审批。值得注意的是,其中8款药物还是之前从未在其他地方获批的新药品(viltolarsen、baloxavir marboxi、gilteritinib fumarat、borofalan、tepotinib、entrectinib;氯苯唑酸葡甲胺新适应症或剂量、西罗莫司新制剂)。
尽管是非肿瘤领域的例证,但是针对COVID-19疫情做出的紧急审批是加速审批通道提高效率最好的证明。巴西国家卫生监督局为应对COVID-19,对各种疗法、诊断和支持性医疗器械授予了特别审批通道。
在关键的时刻战略性地调配监管体系的资源无疑挽救了全世界无数人的生命,作者也希望未来通过加速审批的疗法能够在应对肿瘤治疗和其他未满足需求的关键挑战中发挥更大作用。







