11月12日,中国国家药监局药品审评中心(CDE)网站最新公示,恒瑞医药的PD-1抗体注射用卡瑞利珠单抗又一项上市申请获受理。目前卡瑞利珠单抗已在中国获批四个适应症,涵盖淋巴瘤、肝细胞癌、非小细胞肺癌、食管鳞癌。此外,卡瑞利珠单抗针对不同鼻咽癌适应症的两个申请已于近期分别被纳入优先审评和拟优先审评。

截图来源:CDE官网
卡瑞利珠单抗是恒瑞医药自主研发的一款人源化PD-1单克隆抗体,也是恒瑞医药旗下的重点研发产品。自2019年5月首次在中国获批上市以来,该药已在中国获批四个适应症,分别为:
1)用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤患者的治疗;
2)用于既往接受过标准系统性治疗(索拉非尼和/或以奥沙利铂为主的系统化疗)后疾病进展或不耐受的晚期肝细胞癌患者的治疗;
3)联合培美曲塞和卡铂用于EGFR基因突变阴性和ALK阴性的、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌患者的一线治疗;
4)用于既往接受过一线标准化疗后疾病进展或不可耐受的局部晚期或转移性食管鳞癌患者的治疗。

此外,卡瑞利珠单抗“用于既往接受过二线及以上化疗后疾病进展或不可耐受的晚期鼻咽癌患者的治疗”的申请,已因“符合附条件批准的药品”在今年9月被CDE纳入优先审评。卡瑞利珠单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗的申请在11月6日刚被纳入拟优先审评。
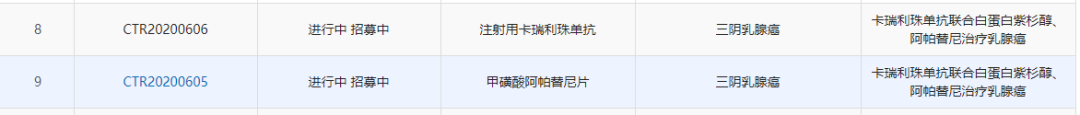
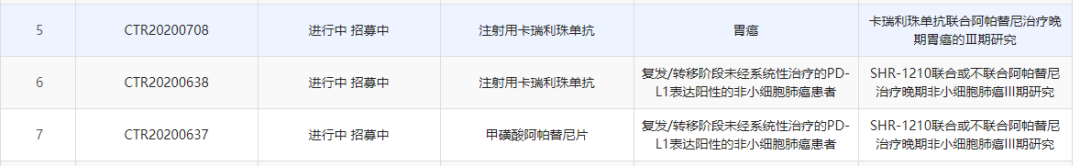
中国药物临床试验登记与信息公示平台显示,恒瑞医药已登记了15项卡瑞利珠单抗的临床试验信息。除了上面提到的适应症外,卡瑞利珠单抗在临床试验中还正在被开发用于治疗三阴性乳腺癌、胃癌、PD-L1表达阳性的非小细胞肺癌、晚期泌尿系统肿瘤、妇科肿瘤、IV期KRAS突变非鳞非小细胞肺癌等癌种。其中针对三阴性乳腺癌、胃癌、PD-L1表达阳性的非小细胞肺癌的3期临床研究正在进行之中。