今日,TG Therapeutics宣布,美国FDA已接受该公司为umbralisib递交的新药申请(NDA),适应症为经治边缘区淋巴瘤(MZL)患者(至少接受过一种基于抗CD20的治疗方案),和经治滤泡性淋巴瘤(FL)患者。Umbralisib是一款每日口服一次的PI3Kδ和CK1-ε双重抑制剂。针对MZL适应症的申请同时被授予优先审评资格,预计在明年2月5日之前获得答复。

边缘区淋巴瘤(MZL)是一组缓慢生长的成熟B细胞非霍奇金淋巴瘤(NHL)。MZL通常被认为是一种慢性不治之症,在美国,MZL是第三大最常见的B细胞NHL,约占所有NHL病例的8%。滤泡性淋巴瘤(FL)是一种起源于B淋巴细胞的非霍奇金淋巴瘤(NHL),FL是最常见的惰性淋巴瘤,约占所有NHL病例的20%。
TG Therapeutics公司开发的umbralisib是一款新一代PI3Kδ抑制剂。它对PI3Kδ的特异性优于其它PI3Kδ抑制剂,不会对PI3γ产生抑制。而且它能够通过抑制名为CK1-ε的蛋白,防止扰乱调节性T细胞的功能,从而提高药物的耐受性。它曾经获得FDA的突破性疗法认定,治疗边缘区淋巴瘤患者。
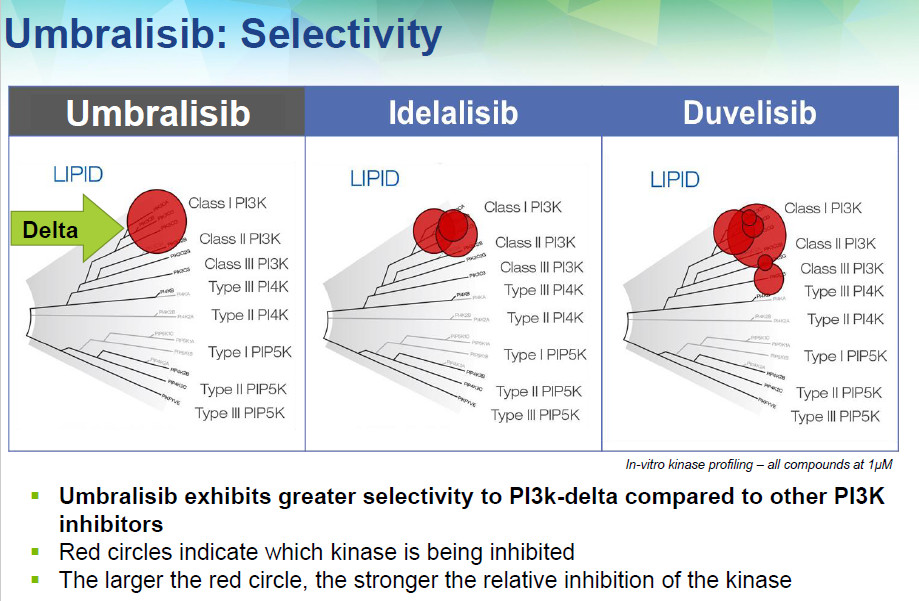
▲Umbralisib对PI3Kδ具有更高的特异性(图片来源:TG Therapeutics官网)
Umbralisib的NDA主要基于名为UNITY-NHL的2b期试验。该试验评估了umbralisib治疗复发/难治性MZL或FL患者的疗效和安全性。TG Therapeutics此前已宣布,每个队列均达到了总缓解率(ORR)的主要终点,ORR达到该公司指定的40%-50%的范围,这一表现得到了独立审查委员会(IRC)的证实。







